Corning® Matrigel®基底膜基质是提取于Engelbreth-Holm-Swarm(EHS)小鼠肿瘤的可溶性基底膜,在室温下凝胶形成真正重建的基底膜。Corning Matrigel基质的主要成分是层粘连蛋白(约60%)、IV型胶原蛋白(约30%)、巢蛋白(约8%)和硫酸肝素蛋白多糖。Corning Matrigel基质中也含有生长因子、胶原酶、纤溶酶原激活物及其他成分。
试剂和材料
● MDCK细胞株(ATCC CCL-34,家犬肾上皮细胞)
● Corning Matrigel 基底膜基质(Corning,货号356234)
● MEM培养液(Corning,货号10-009-CV)
● 胎牛血清FBS(Corning,货号35-015-CV)
● 磷酸盐缓冲液PBS (Corning,货号21-040-CV)
● 0.25%胰蛋白酶/ EDTA(Corning,货号25-053-Cl)
● 24孔板(Corning,货号3524)
操作流程1. 胶上3D培养
1. 使用前将Matrigel基质小瓶浸入置于4°C冰箱的冰中过夜解冻。Matrigel解冻后,旋转小瓶以确保混匀。
2. 向预冷的24孔板中加入200μL/孔的Matrigel(8-11mg/mL),用移液枪头迅速均匀铺开,在37℃下孵育30分钟使Matrigel成胶。
注意:与Matrigel基质接触的所有培养器皿、耗材和培养液均应预冷。整个实验过程中需始终保持Matrigel置于冰上。在Matrigel凝胶过程中不要使其过度干燥。
3. MDCK细胞用PBS洗一次,胰酶消化并制备单细胞悬液,室温下125×g离心5分钟沉淀细胞。
注意:使用状态良好且不超过85%汇合度的细胞。MDCK细胞易于成团,通常需用移液器吹打以获得单细胞悬液。
4. 用MDCK完全培养液(MEM + 10%FBS)重悬细胞,调节细胞密度至3×105个/ mL,取250μL细胞悬液加入到Matrigel包被的24孔板中,37℃下孵育30分钟。
注意:接种细胞数量可能需要根据细胞的生长特性进行优化。
5. 冰上冷却MDCK完全培养液,加入终体积10%的Matrigel基质(终浓度:0.8-1.1mg / mL)。取250μL的Matrigel基质/培养液混合物,轻轻加入到24孔板中。
注意:培养液在加入Matrigel基质之前必须彻底冷却,以确保Matrigel基质混合均匀,并能均匀沉积在培养基中的细胞上。将Matrigel基质/培养液混合物沿孔的侧壁加入,避免扰动细胞和Matrigel基质胶。
6. 继续培养4至7天,每2天更换一次Matrigel基质/培养液混合物。
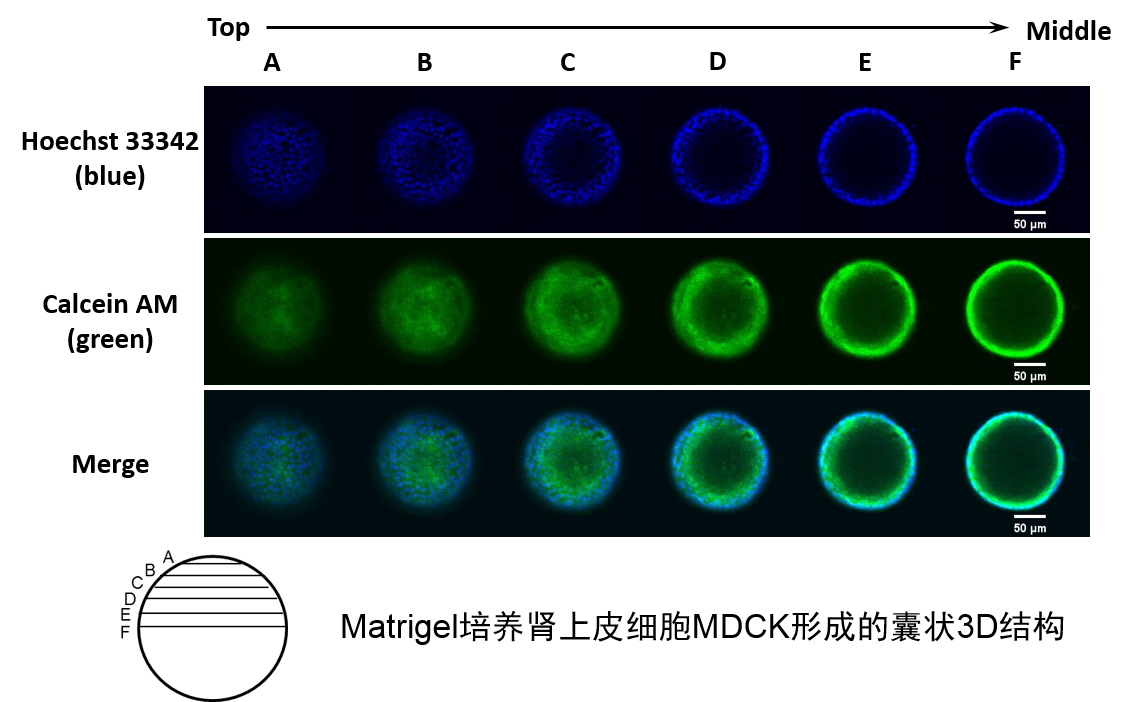
7. 建议对3D培养物进行免疫染色,使用共聚焦显微镜观察细胞形态。
操作流程2. 嵌入式3D培养
1. 使用前将Matrigel基质小瓶浸入置于4°C冰箱的冰中过夜解冻。Matrigel解冻后,旋转小瓶以确保混匀。
2. 在第0天,用预冷的MDCK完全细胞培养液(MEM + 10%FBS)将Matrigel基质稀释至5mg / mL。
注意:整个实验过程中,与Matrigel基质接触的所有培养器皿、耗材和试剂均应始终置于冰上。
3. 使用预冷的枪头向预冷24孔板每个孔中加入100μL的Matrigel基质(5mg / mL),用枪头均匀铺开,37℃孵育30分钟形成凝胶。
注意:在Matrigel凝胶过程中不要使其过度干燥。
4. 用胰蛋白酶消化单层MDCK细胞以制备单细胞悬液,室温下125×g离心5分钟沉淀细胞。
注意:使用状态良好且不超过85%汇合度的细胞。MDCK细胞易于成团,通常需用移液器吹打以获得单细胞悬液。
5. 用MDCK完全培养液重悬细胞,调整细胞密度至5×106个细胞/ mL。取30μL制备的细胞悬液,加入到270μL置于冰上的Matrigel基质溶液(5mg / mL)中,最终细胞密度为5×105个/ mL。37℃孵育30至45分钟。
注意:细胞悬液的体积不应超过Matrigel基质溶液的10%以上,以确保稀释的基质胶溶液能够凝结成胶。接种细胞数量可能需要根据细胞系的生长特性进行优化。
6. 轻轻地向每个孔中加入500μL MDCK完整培养液。
7. 继续培养8至10天,每2天更换一次培养液。
8. 建议对3D培养物进行免疫染色,使用共聚焦显微镜观察细胞形态。
培养结果
荧光染色后,共聚焦显微镜观察Matrigel培养的细胞,形成3D囊状结构
参考文献
1. Genee Y Lee, et al., Nature Methods. 4(4):359-365 (2007).
2. Natalie Elia, et al., Curr Protoc Cell Biol. Chapter 4:Unit 4.22 (2009)